

走进尊龙凯时
NEWS尊龙凯时创新技术打造类CAR NK细胞
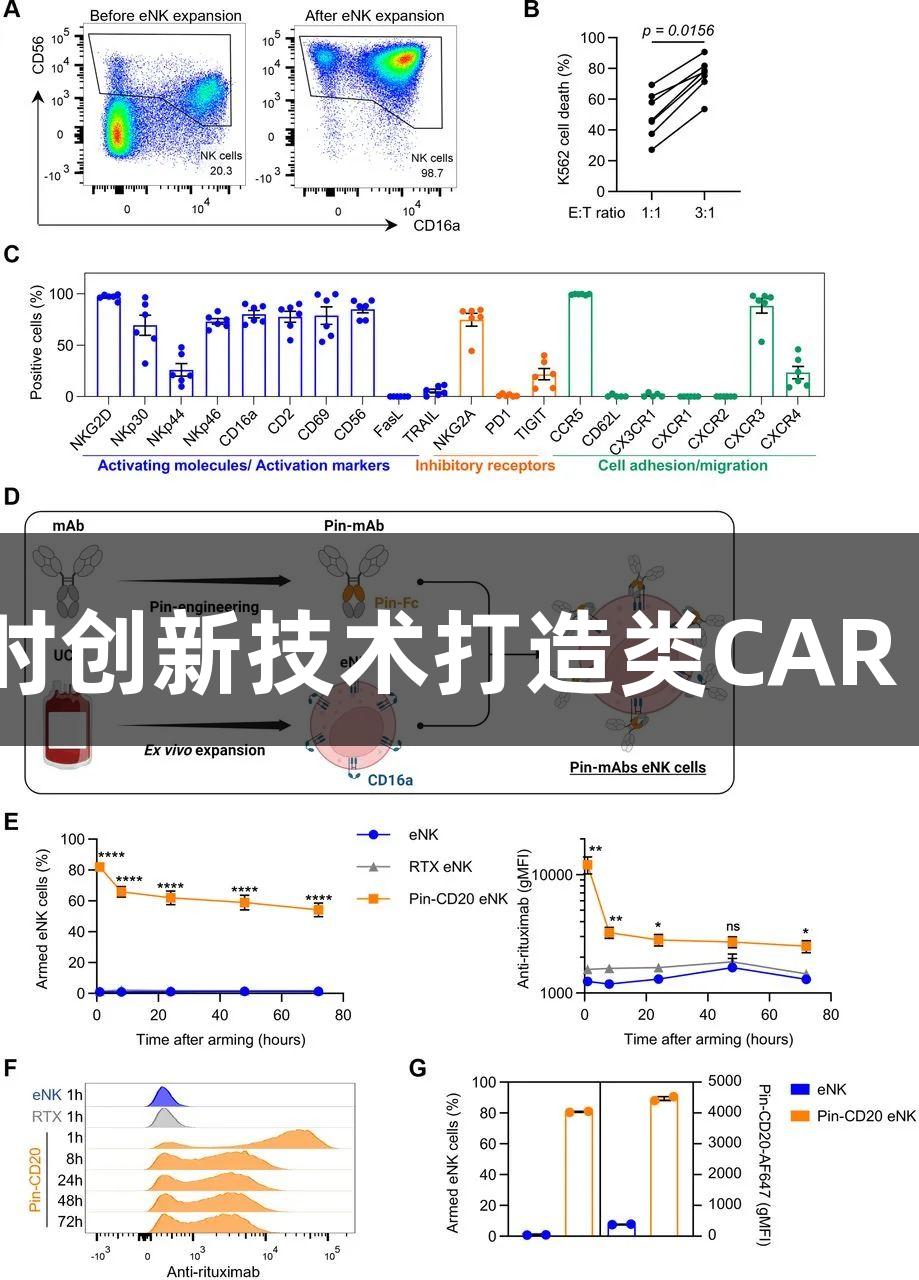
来源:叶骅哲 日期:2025-03-17自然杀伤(NK)细胞在肿瘤治疗领域被普遍认为比T细胞更加安全可靠。因此,针对CD19靶点的嵌合抗原受体(CAR)-NK细胞在淋巴B细胞肿瘤患者的治疗中显示出其安全性与有效性。然而,CAR-NK细胞的制备过程复杂且成本高昂。在本研究中,我们采用了一种名为“别针”(Pin)的非基因修改技术,旨在生产具有抗肿瘤效能的NK细胞。该方法利用脐血单个核细胞(PBMCs),结合细胞因子IL-2/IL-15及转染了爱波斯坦-巴尔病毒(EBV)的B淋巴母细胞进行NK细胞的生成,并通过改良抗CD20和抗CD19抗体(具有更高亲和力的抗体)来孵育扩增NK细胞。最终生成的NK细胞在细胞膜表面附带抗CD19/CD20抗体,能够通过抗体依赖性细胞毒性显著增强对CD19或CD20阳性肿瘤细胞的杀伤效果,达到与CAR-NK细胞类似的治疗效果。
别针单抗的生产和纯化是通过对人类IgG1的Fc的CH2结构域的四个氨基酸进行改造:S239D/H268F/S324T/I332E。所有的别针抗体均由RD-Biotech(Besançon, France)进行生产,并使用CHO细胞合成及蛋白A纯化过程。其序列来自于临床使用的单抗,包括别针-CD20单抗来源于利妥昔单抗,别针-HER2单抗来源于曲妥珠单抗,别针-EGFR单抗来源于西妥昔单抗,别针-CD19单抗来源于布纳吐莫单抗。
供试的细胞系如K562、Daudi、Toledo、Raji等均来自ATCC或ECACC,而悬浮细胞的培养则是在含10% FBS的RPMI-1640 GlutaMAX培养基中进行;HCT116、MDA-MB-468、MCF7细胞则在高糖的DMEM培养基中生长。淋巴瘤患者的细胞样本来自蒙彼利埃CHU的CRB-CHUM平台。在抗体定量的细胞系和患者样本中,CD19和CD20的绝对值采用BD藻红蛋白PE荧光定量试剂盒与BDFACSCanto II流式细胞仪相结合进行定量检测。
在NK细胞体外扩增过程中,使用EasySep人类CD3阳性分选试剂盒II从脐血单个核细胞中去除CD3阳性细胞,剩余的PBMCs在含10% FBS(RPMI-1640)或5%人类血清(NKMACS)的培养基中进一步培养,并添加100 IU/mL的IL-2与5 ng/mL的IL-15。在培养至第5至第7日时,每2-3天全部更换新鲜培养基,确保NK细胞密度至少达到0.6×10^6个细胞/mL,并在14至20天后结束培养。同时,EBV转染的B淋巴母细胞作为滋养层细胞在辐照后以合适比例加入培养体系中。在扩增结束时,收集2×10^5个扩增后的NK(eNK)细胞进行流式细胞术检测多种标志物的表达,如CD56、CD45、CD57等。
eNK细胞后续则使用Muse细胞分析仪进行计数,之后以2×10^6个细胞/mL的浓度在含10μg/mL别针-CD20/CD19/EGFR/HER2单抗的RPMI-1640 GlutaMAX培养基中孵育1小时。在某些实验中,别针单抗可能会事先用荧光染料标记以便后续分析。细胞毒性检测使用CFSE或CellTrace FarRed标记的靶细胞,根据特定的E:T比进行混合共培养24小时,最终通过流式细胞术检测靶细胞被杀伤的程度,并收集培养基上清用于分泌性因子的含量分析。
在体内细胞毒性实验中,我们使用的NSG小鼠由IGMM购买,用于观察在注射别针注射eNK、别针CD20-eNK、别针CD19-eNK后的表现,并通过流式细胞术分析eNK细胞的存活率和体内细胞毒性能力。对于建立的小鼠体内白血病模型,在肿瘤细胞注入后的第4天和第8天,实施两次粪便注射30×10^6个细胞(eNK或别针-CD20eNK)。最终结果显示,尽管CD16a的F158V多态性对别针抗体结合CD16a存在一定影响,但在不同eNK类型上的抗体依赖性细胞毒性并未观察到显著性差异。
综上所述,研究表明,经过别针抗体增强的eNK细胞可以高效清除CD20阳性靶细胞。通过使用两种别针单抗武装eNK,打造双抗体eNK,其表现出相似的结合动力学与强大的抗肿瘤能力。这些研究结果为未来更高效的NK细胞疗法奠定了基础,展示出尊龙凯时在肿瘤免疫治疗领域的潜力与努力。
全国客户服务热线
17080373516
总部地址:武汉牧野区谌街道36号